ROS1融合突變和靶向藥物
2016-08-09 由 癌度 發表于資訊
.jpg)
ROS1基因也是肺癌中經常被提及的基因突變,但是其突變頻率並不是特別高。另外很多患者和家屬沒有分清楚ROS1的突變形式,很多不靠譜的基因測序公司,對於ROS1基因上一個位點的突變都解析是藥物敏感突變,對患者的靶向用藥產生了極大的干擾。本帖注重對ROS1的基因突變形式、對應的靶向藥物做一次系統梳理。
1、認識ROS1基因和其突變
ROS1基因的重排最開始是在人腦膠質瘤細胞系裡被鑑定出來,後續在其他幾個惡性腫瘤里也發現了ROS1基因的重排,如膽管癌、卵巢癌、胃癌和非小細胞肺癌,其中在非小細胞肺癌里的突變頻率為1%-2%。ROS1基因可與多個基因發生融合突變,其中最主要的融合伴侶是CD74,(見下面圖片),ROS1與其他基因發生融合時,一般會保留激酶結構域,而且在斷裂點上較為保守。ROS1的重排導致激酶持續激活,上調SHP-1、SHP2以及PI3K、AKT、mTOR、MAPK和ERK信號通路,導致細胞持續增殖,腫瘤發生。
.jpg)
圖1:非小細胞肺癌中ROS1基因的融合形式
上圖是ROS1基因的融合形式,左側的綠色部分為ROS1的酪氨酸激酶結構域,藍色部分為跨膜結構域。右側部分是報導的與ROS1發生融合變異的基因和其頻率。由於存在多種基因可能與ROS1基因發生融合,因此在選擇檢測ROS1的變異時,需要著重技術原理,避免漏檢。檢測ROS1突變的技術有FISH(原位免疫螢光雜交)、RT-PCR(逆轉錄PCR)、IHC(免疫組化)和新一代測序(NGS)。目前FISH是ROS1融合的金標準,通過紅色和綠色螢光探針標記ROS1基因兩端,如果ROS1基因沒有發生斷裂,那麼紅綠螢光湊在一起表現為黃色螢光信號。如果ROS1基因中間發生了斷裂,則可以觀察到紅色螢光、綠色螢光信號的分離,如果大於15%的腫瘤細胞呈現出這種分離信號,則判斷為ROS1基因融合突變陽性。
.jpg)
圖2:FISH檢測ROS1基因的重排
需要認識到任何檢測技術都不是完美的,FISH的優勢是可以檢測石蠟切片組織(FFPE),這是RT-PCR不能具備的,RT-PCR對樣本的RNA要求較高,需要新鮮的組織樣本提取RNA才能進行逆轉錄。另外FISH還可以檢測一些未知的融合突變,即不需要知道ROS1基因的融合伴侶是誰,只要ROS1發生分離了就行。缺點是手續繁瑣、對試驗員的操作要求較高。另外FIG基因在ROS1上游134kb處,因此FIG-ROS1的融合形式在螢光信號分離上不是很好判斷。最關鍵的是FISH不能提供出和ROS1發生融合的伴侶基因是什麼,是否有生物學和臨床的意義。
RT-PCR因為需要之前設計引物,所以不能檢測未知的融合突變形式。對樣本的RNA要求較高,石蠟標本里RNA降解很嚴重。因此如果您的檢測報告表明是RT-PCR檢測的融合突變,而您的標本是石蠟標本,那麼就需要注意是否存在假陰性的情況,不管是ALK或者ROS1以及RET都是這種情況。RT-PCR的優勢是快速、樣本需求量少。
ROS1的免疫組化檢測特點是簡單,易操作。但是對抗體的要求較高,另外易受到染色背景、判讀標準的影響,也有很多地方亟待提升。總之對於ROS1基因的融合突變,最好使用兩種以上的檢測技術進行相互驗證,沒有一項技術是可以做到100%的承諾的保證的,但是對於患者來說,漏檢因為所有的希望。
2、ROS1的患者和病理特點
ROS1融合突變是非小細胞肺癌的一個亞型(突變頻率1%-2%),ROS1的患者群與ALK突變的患者擁有一些共同的特徵,患者的特點是年輕、非吸菸、亞裔、進展較快。儘管ROS1融合突變也在肺大細胞癌、鱗狀細胞癌里被鑑定出來過,但是ROS1主要是存在於肺腺癌中。
ROS1基因與其他驅動基因突變是不共存的,一項涵蓋1073個樣本的研究表明ROS1與EGFR、ALK等突變互斥,沒有發現他們共同存在。一項涵蓋556個患者的研究也表明,使用免疫組化IHC檢測ALK和ROS1,沒有發現二者共存。後續有報導研究兩名ROS1陽性的患者發現了EGFR突變,分別是L858R和19號外顯子缺失突變。但是這些為個別案例,總體上腫瘤的驅動基因都是互相排斥的,因為腫瘤也不需要兩種驅動基因驅動其增殖。
3、治療ROS1陽性的克唑替尼
由於ROS1突變與ALK的相似性,研究者很容易想到使用ALK的抑制劑去嘗試治療ROS1的突變。2014年公布的臨床研究數據表明,50名患者每日兩次口服250mg克唑替尼,客觀應答率(ORR)為72%,包含3例患者完全緩解(CR),33例患者部分緩解(PR)。相比ALK突變,ROS1患者使用克唑替尼的反應持續時間更長,達到17.6個月,中位無進展生存期(PFS)為19.2個月,因此專家推出克唑替尼對ROS-1的抑制要強於ALK,而且ROS1陽性突變的患者預後相對較好。
美國FDA於2016年3月11日批准將克唑替尼用於治療ROS1突變的轉移性非小細胞肺癌患者。也是第一個FDA批准的ROS1陽性的靶向藥物。但是克唑替尼治療ROS1陽性的患者也不可避免為會產生耐藥,這些耐藥原因包含ROS1基因上的一些點突變,如G2032R、L2155S、L2026M、G2101A、K2003I、L1951R等。其中ROS1的G2101A、L2026M和G2032R的腫瘤細胞系對Foretinib敏感,但是L2155S對於Foretinib仍然耐藥。G2032R和L2155S細胞系對TAE684也是不敏感的。除去這兩個藥物外,卡博替尼(XL184)展示出與部分耐藥位點的療效,如圖3,ROS1陽性克唑替尼耐藥後的L2026M、L1951R和G2032R可以被卡博替尼所解決,對於ROS1陽性的患者來說這算是一個好的事情,雖然這些是細胞系的研究,但是希望還是有的。這些需要著重注意,基因檢測報告需要仔細查詢是否有這些耐藥位點,這些耐藥位點的釋義和相應的意義。
.jpg)
圖3:ROS1的G2032等突變對卡博替尼敏感
ROS1患者在克唑替尼使用的另一個耐藥機制是EGFR的代償性高表達(表達量為2.6倍),這個在腫瘤細胞系中獲得了驗證,同時使用EGFR的靶向藥物吉非替尼或西妥昔單抗聯合克唑替尼,可以起到協同抑制的作用(見圖4)。
.jpg)
圖4:克唑替尼聯合達克替尼或阿法替尼,可控制部分ROS1患者的耐藥
但是問題是,假如EGFR的高表達也確實是一部分ROS1患者的耐藥原因,什麼時候對患者進行檢測呢,使用什麼樣本檢測。檢測的靈敏度和特異性如何?
鈣粘附蛋白E表達量丟失,波形蛋白和人纖維連接蛋白表達增加是另外一種ROS1陽性患者對克唑替尼耐藥的原因。這導致細胞形態,以及細胞之間的粘附力出現改變。
.jpg)
圖5:一些蛋白表達降低或升高也影響ROS1患者對克唑替尼的敏感性
另外也有文獻報導KRAS、NRAS等也對ROS1陽性的患者使用克唑替尼耐藥,從腫瘤細胞的進化考慮,ROS1對克唑替尼的耐藥原因會是比較複雜的,也比較難以預測。因此究竟是什麼原因耐藥,一定要徹底進行檢測明確。推薦什麼類型的靶向藥物,必須有一定的文獻或臨床數據支持。
4、其他ROS1融合陽性的靶向藥物
ALK和ROS1的激酶活性區域有70%的相似性,因此ALK的抑制劑很多是可以用於ROS1的治療的,克唑替尼這個藥物也就是這麼誤打誤撞地搞出來的。其他的ALK抑制劑是否也可以呢?答案是有抑制效果但不都是。
.jpg)
圖6:ALK抑制劑對ROS1-CD74融合基因的抑制情況
在圖1上我們可以知道CD74是ROS1的主要融合伴侶基因,所以表達該融合基因的細胞系被用來測試ALK的抑制劑。從圖6我們可以看出,克唑替尼、色瑞替尼(LDK378)、AP26113對ROS1-CD74的抑制效果很不錯。ASP3026具有中度的抑制效果,艾樂替尼(CH5424802)沒有顯示出具有抑制活性,這個是為主要注意的,因為艾樂替尼在ALK中和克唑替尼的頭對頭臨床試驗效果很好,但是這並不能完全複製到ROS1陽性的患者上,最起碼不能複製到CD74-ROS1的融合突變的患者上。
很多病友都熟悉3922這個ALK抑制劑,有資料稱這個藥物對於ROS1的抑制力度比克唑替尼強幾十倍。我們查詢了很多的文獻,終於找到了一篇3922對ROS1的報導,給大家呈上。
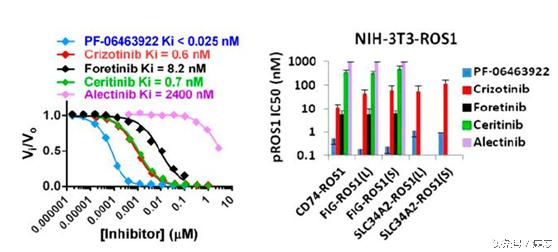
圖7:不同ALK抑制劑對ROS1的抑制活性,3922最優
從圖7中我們可以再次了解ALK抑制劑對ROS1突變的抑制活性,其實3922可以說是一騎絕塵。當然在這裡我們再一次看到艾樂替尼對ROS1抑制不力,這個是需要著重注意的,不是所有的ALK抑制劑對ROS1都能起到好的抑制效果。
對於ROS1突變導致的克唑替尼耐藥,體外實驗表明3922可以ROS1基因上的G2032R突變、G2026M突變具有抑制效果。在動物模型的體內實驗上,3922對於FIG-ROS1、CD74-ROS1和存在G2032R耐藥突變的CD74-ROS1都具有抑制活性。另外對於FIG-ROS1陽性膠質母細胞瘤的老鼠上也展示出抑制效果。這裡需要注意ROS1有多個耐藥突變,目前報導的是其中兩種是可以用3922控制的,當然這是動物實驗,後續仍需要進行跟蹤了解。
結語:
我們就本帖進行一次重點總結:
ROS1的突變頻率不是很高,在非小細胞肺癌里的頻率僅為2%左右,但是目前有靶向藥物克唑替尼批准。需要明確的是ROS1的突變形式是與其他基因發生融合。但是ROS1本身會產生一些耐藥突變對克唑替尼耐藥,這些耐藥位點可以被其他靶向藥物所解決,如卡博替尼、3922等。目前ROS1在其他癌種也有發現,但是跨癌種用藥的療效如果目前沒有較為全面的報導,有膠質母細胞瘤腦的ROS1陽性老鼠對3922敏感。其他癌種如果檢測出來ROS1陽性,且沒有獲準的靶向藥物,跨癌種用藥也是可以考慮的。
參考文獻;
1、Kurtis D. Davies, et al., Clin Cancer Res. 2013 August 1; 19(15): 4040–4045.
2、Gainor JF, et al., Oncologist. 2013;18(7):865-75.
3、Song A,et al.,Clin. Cancer Res. 21, 2379–2387(2015).
4、Katayama R, et al.,Clin Cancer Res. 2015 Jan 1;21(1):166-74
5、Zou HY, et al., Proc Natl Acad Sci U S A. 2015 Mar 17;112(11):3493-8.
原文網址:https://kknews.cc/news/8636l4.html
.jpg)











.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)














.jpg)

.jpg)