港大醫學院發現肝癌新代謝途徑 開闢新的治療方向
2022年06月09日
香港大學李嘉誠醫學院(港大醫學院)臨床醫學學院病理學系的研究團隊發現了肝癌細胞的一種新的代謝途徑。團隊發現,肝癌細胞利用一種名為巨胞飲(macropinocytosis)的細胞內吞過程,即透過吞噬細胞外蛋白質作為燃料,以支持肝細胞癌(HCC)在缺氧條件下無限生長。是項發現顯示,針對巨胞飲作用或可作為一種有效治療 HCC 的新方法。有關研究結果已在著名跨學科科學期刊《自然通訊》(Nature Communications)上發表(按此瀏覽期刊文章)。
研究背景
肝細胞癌是最常見的原發性肝癌類型。在香港,肝癌是第五大常見癌症和第三大致命癌症。儘管肝癌的治療選擇越來越多,但晚期肝細胞癌患者的存活期仍少於兩年。
血液輸送的氧氣是肝細胞癌的重要養分,惟由於腫瘤的異常生長速度遠遠高於血管生成速度,導致腫瘤(包括肝細胞癌)的含氧量往往低於正常器官組織。HCC 細胞通過穩定一種稱為缺氧誘導因子-1(HIF-1)的轉錄因子,而對這種缺氧之「營養限制」具有高度適應性和抗壓力。港大醫學院的研究團隊發現了由 HIF-1調節的一種基因EHD2,通過啟動依賴巨胞飲作用的代謝程序,以促進 HCC 細胞適應缺氧這「營養限制」並持續生長;研究亦顯示,針對巨胞飲作用通路作為治療方向,或可有效抑制肝細胞癌。
研究方法和發現
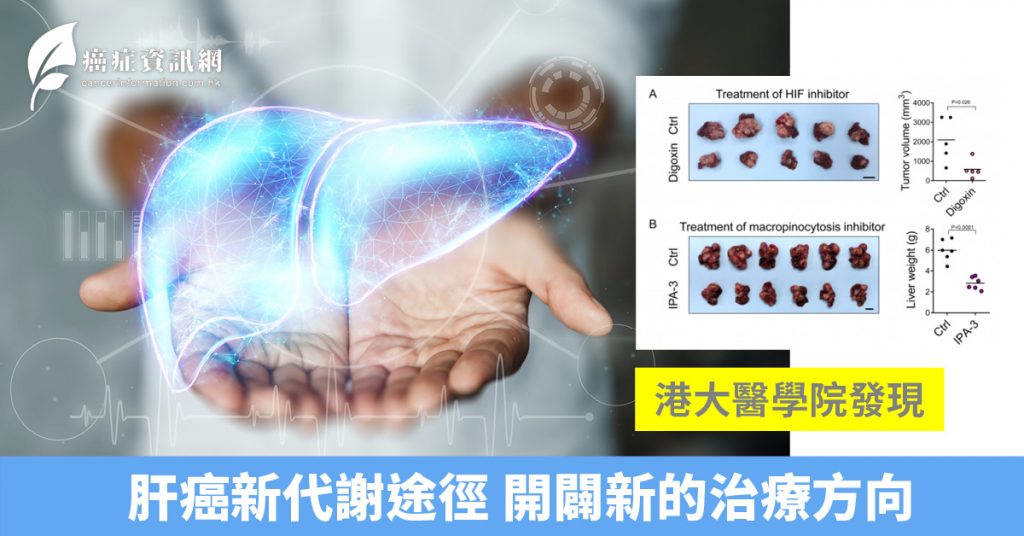
巨胞飲是一種細胞內吞機制,允許細胞吞噬細胞外的蛋白質。通過共聚焦顯微鏡,研究團隊發現在缺氧條件下,能提高HCC細胞的巨胞飲水平達5至10倍。研究團隊通過質譜分析進一步發現,巨胞飲作用吞噬的蛋白質在細胞內被降解為氨基酸,這些氨基酸可作為肝癌細胞生長的燃料。在分子機制上,這一過程由HIF-1 轉錄激活一種稱為 EH 結構域蛋白 2(EHD2)的基因所介導。 EHD2驅動膜皺褶的形成,是促使巨胞飲順利進行的首個關鍵步驟。研究團隊從動物實驗中發現,在小鼠內剔除EHD2基因,可有效抑制肝細胞癌生長。HIF抑制劑Digoxin或巨胞飲抑制劑 IPA-3 ,均在小鼠 HCC 模型中成功抑制腫瘤生長超過 50%(圖A、圖B)。更重要的是,基因EHD2 在約四成肝細胞癌患者中顯著過度表達至少兩倍以上。綜上所述,是項研究結果揭示了一個新的代謝途徑,即HIF-1/EHD2 介導的巨胞飲會支持肝細胞癌生長。因此,抑制巨胞飲作用或為一種治療肝細胞癌的可行方法。
研究意義
是項研究的首席研究員、港大醫學院臨床醫學學院病理學系副教授黃澤蕾博士表示:「肝癌有較差的預後結果,其中一個原因是癌細胞非常聰明,善於在不利的環境下適應求存。因此,了解肝癌的生物學和代謝學有助尋找有效的治療重點和方法。在這項研究中,我們發現肝癌細胞會通過另類且特殊的代謝機制,從環境中吞噬蛋白質作為營養來源。我們亦發現 HIF-1/EHD2 通路會促進巨胞飲介導的癌症代謝重整能力,為設計針對巨胞飲的創新癌症治療策略提供了重要的分子基礎。重要的是,缺氧現象不只存在於肝癌中,亦見於所有腫瘤,因此,我們這項研究的發現也將適用於其他癌症類型。」
研究團隊
是項研究由香港大學李嘉誠醫學院臨床醫學學院病理學系副教授、肝病研究國家重點實驗室(香港大學)首席研究員黃澤蕾博士領導,並擔任通訊作者。第一作者是港大醫學院臨床醫學學院病理學系博士後研究員張碩博士,並由研究助理崔迪博士、博士後研究員李揚俊博士、趙公雋博士和吳綺靜博士提供協助。研究團隊的其他成員包括:港大醫學院臨床醫學學院病理學系研究生袁瑋軒先生、招詠心小姐、包皓然先生、黃寶儀小姐、陳懿玲小姐、技術主任謝沛樺小姐;港大醫學院臨床醫學學院病理學系副教授、肝病研究國家重點實驗室(香港大學)首席研究員黃俊銘博士;港大醫學院臨床醫學學院病理學系講座教授、陸佑基金教授(病理學)兼肝病研究國家重點實驗室(香港大學)主任吳呂愛蓮教授。
癌症資訊網