港大生物學家揭示巨噬細胞促進卵巢癌腹膜轉移的新機制
為治療策略提供重要見解
香港大學(港大)生物科學學院的研究小組發現,癌細胞能利用與腫瘤相關巨噬細胞之間一種新的相互作用來促進卵巢癌的腹膜轉移。這些研究結果為卵巢癌的治療策略提供了重要的見解,並已於國際著名科學期刊《先進科學》(Advanced Science)上發表。
研究背景
卵巢癌患者的死亡率位列衆多婦科癌症中之首,原因是超過七成患者在罹病晚期才得到診斷,此時癌細胞多已在腹腔擴散,難以治療。
基於腫瘤的異質性(tumour heterogeneity),個別癌細胞的形態和表型特徵都各有不同,而癌細胞與腫瘤微環境(tumour microenvironment)之間存在多層的互動,都令治療卵巢癌的腹膜轉移變得非常困難。
在腹膜轉移的過程中,研究細胞和分子機制是找出治療方法的關鍵,但缺乏合適的實驗模型為研究帶來重重障礙。另外,傳統的細胞實驗普遍採用批量檢測,因此科學界對於單個不同的癌細胞亞克隆(subclone)和腫瘤微環境之間獨特的相互作用仍不甚了解。
研究方法和成果
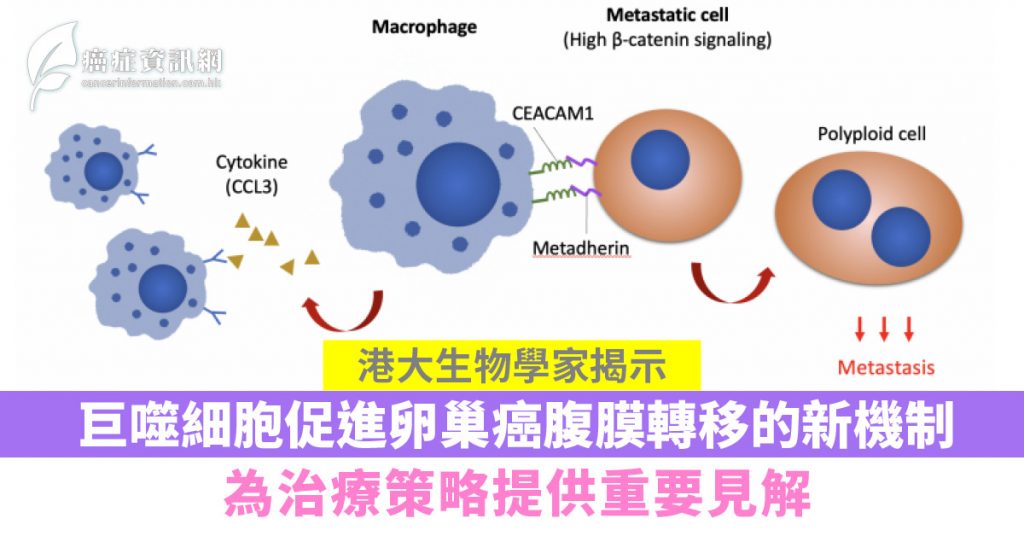
主要發現:團隊通過觀察人源化小鼠模型發現,Wnt/β-catenin信號通路提升轉移卵巢細胞表面的metadherin蛋白,進而通過巨噬細胞表達的CEACAM1傳遞信號。因此,通過抑制metadherin或CEACAM1來阻斷巨噬細胞與癌細胞的通訊,能有效減少在免疫細胞中的腹膜轉移。
研究團隊早前基於癌細胞的異質性,建立了一個可以模擬卵巢癌自發轉移的等基因實驗模型。研究人員利用該模型加上基因測序及生物信息學分析後,發現Wnt/β-catenin信號通路在具有高轉移能力的卵巢癌細胞中有所上調。Wnt/β-catenin信號通路在胚胎發育和保持組織的恆定狀態,以至癌症中皆扮演重要角色;信號的上調會增加其他致癌基因的表達而造成癌細胞的擴散。
巨噬細胞具有協調先天免疫和適應性免疫反應的關鍵作用,亦是卵巢癌腫瘤微環境中數量最多的免疫細胞。團隊運用「活細胞實時成像」分析單個細胞的活動行為時,發現轉移細胞在與巨噬細胞共同培養的情況下,有一部分轉移細胞會較容易轉型成為「多倍體」,即一種可以促進腫瘤侵略性和治療抗性的表型。另一方面,實驗顯示轉移細胞可將巨噬細胞極化為與腫瘤相關的表型,相應有助轉移細胞形成多倍體。後續的分子分析顯示β-catenin信號通路可上調癌細胞表面的metadherin蛋白,進而通過巨噬細胞表達的CEACAM1傳遞信號。團隊將人類卵巢癌細胞移植到免疫系統人源化小鼠(immune humanized mice)上,證明通過抑制metadherin或CEACAM1來阻斷巨噬細胞與癌細胞的通訊,能有效減少腹膜轉移。由於metadherin和CEACAM1這兩種蛋白是位於細胞的表面,因而非常適合用作追踪癌細胞和臨床靶向。
研究意義
多倍體和基因組不穩定性是癌病的標記。此項研究的重點在於發現了轉移細胞與巨噬細胞的直接相互作用是導致多倍體和基因組不穩定性的潛在驅動機制,即造成癌細胞擴散的原因之一。而當中揭示的分子信息通路有助研發抑制轉移細胞多倍體形成的治療策略,以控制卵巢癌的腹膜擴散。
領導此研究的港大生物科學學院院長(暫任)黃思齊教授認為這項研究極具啓發性:「到目前為止,我們對調節癌症多倍體的機制所知甚少,而我們的研究提供了一種分子機制原理,說明以β-catenin或其下游信號分子為靶點,或許能阻止與預後(Prognosis)不良相關的腹膜擴散。」研究團隊計劃更深入地探索在轉移細胞中驅動多倍體形成的信號傳導機制,這將大大增進我們對卵巢癌基因組不穩定的理解。
研究團隊
此項研究由黃思齊教授(港大生物科學學院)和史珏副教授(香港浸會大學(浸大)物理系)共同領導。杜潔欣博士(港大生物科學學院博士後研究員)為此研究的第一作者,並由鄧紀旋博士(InnoHK創新香港研發平台「合成化學暨化學生物學實驗室」博士後研究員、港大生物科學學院榮譽副研究員)和童寅博士(港大病理系博士後研究員)協助。其他參與研究的合作者包括張江文副教授(港大生物科學學院)、陳嘉倫醫生(港大婦產科學系臨床副教授)及葉品正醫生(港大病理系臨床副教授)。
癌症資訊網