ASCO2021值得關注的臨床腫瘤學科研成果

[醫藥新聞] 美國臨床腫瘤學會(ASCO)代表所有關心癌症患者的腫瘤學專業醫生的一個專業組織,由於擁有超過45,000名會員,所以它的公信力和認受性很強,每年在年會發佈的臨床腫瘤最先進研究和藥物發展趨勢,深受全球關注。
今年(ASCO 2021)會議因疫情影響而改在線上舉行。現把一連五日(2021年6月4日至6月8日)於會議裡備受關注的臨床腫瘤學科研成果及臨床數據公布,因為發布結果正面和豐碩,令人振奮雀躍,希望為癌症患者帶來治療新希望,現挑選部份成果摘要如下︰
多類型腫瘤患者的盼望——MGC018
MarcroGenics承接ASCO 2020藥物科研發展——靶向B7-H3的抗體偶聯藥物(ADC)能夠將DNA烷基化劑杜卡黴素(duocarmycin)遞送到表達B7-H3的細胞中。今年進一步把這種基於倍癌黴素靶向B7-H3的抗體偶聯藥物MGC018,由人源化靶向B7-H3的抗體與倍癌黴素DNA 烷基化有效載荷結合。(詳見圖一)
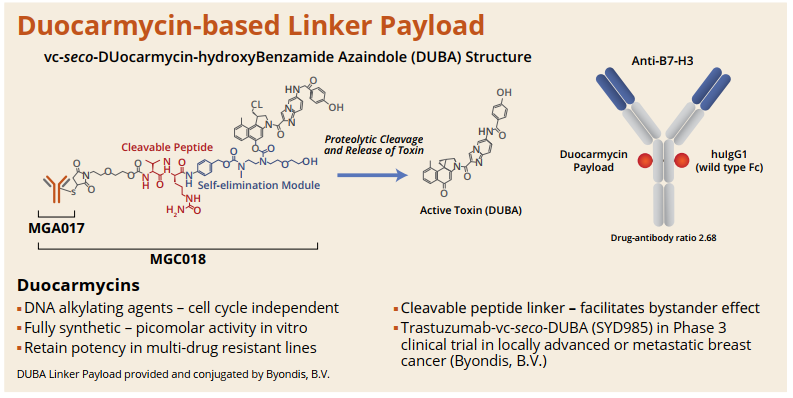 資料來源︰AACR 2020 (圖一)
資料來源︰AACR 2020 (圖一)
所謂B7-H3是免疫調節分子B7家族成員,在多種實體瘤中表達,它與疾病的嚴重程度和不良預後相關,臨床前潛質便成為可發展的研究方向。研發者預設癌症患者已達到複雜和難治的情況,希望MGC018能夠誘導免疫記憶、介導免疫調節活性,並增強與檢查點阻斷劑聯合用藥的抗癌活性等,期望在治療領域尋求突破。(詳見圖二)
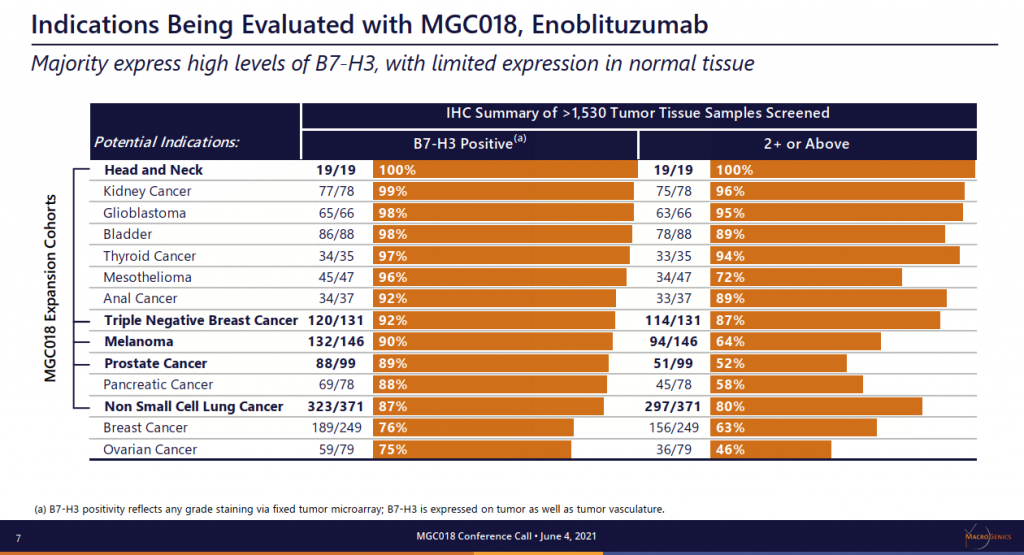 資料來源︰Macrogenics 官網 / ASCO 2021 (圖二)
資料來源︰Macrogenics 官網 / ASCO 2021 (圖二)
註︰Enoblituzumab是一款經過免疫分子優化的、針對B7-H3靶點的全新單克隆抗體,由MacroGenics採用獨家Fc優化技術開發,具有獨特抗體優勢和治療潛力。
在ASCO 2021會議MGC018公布一項劑量遞增研究,他們招募29名已覆蓋多類型腫瘤的患者,包括經先前接受≥2線檢查點治療的3例復發性黑色素瘤患者,並採用3+3+3劑量遞增設計,每3週靜脈注射MGC018。結果顯示可接受的安全性,早期臨床活性、先前治療的轉移黑色瘤的3名黑色素瘤患者的腫瘤全部縮小(分別是24.4%、27.5%和35%),包括1例未確認的PR。(詳見圖三)
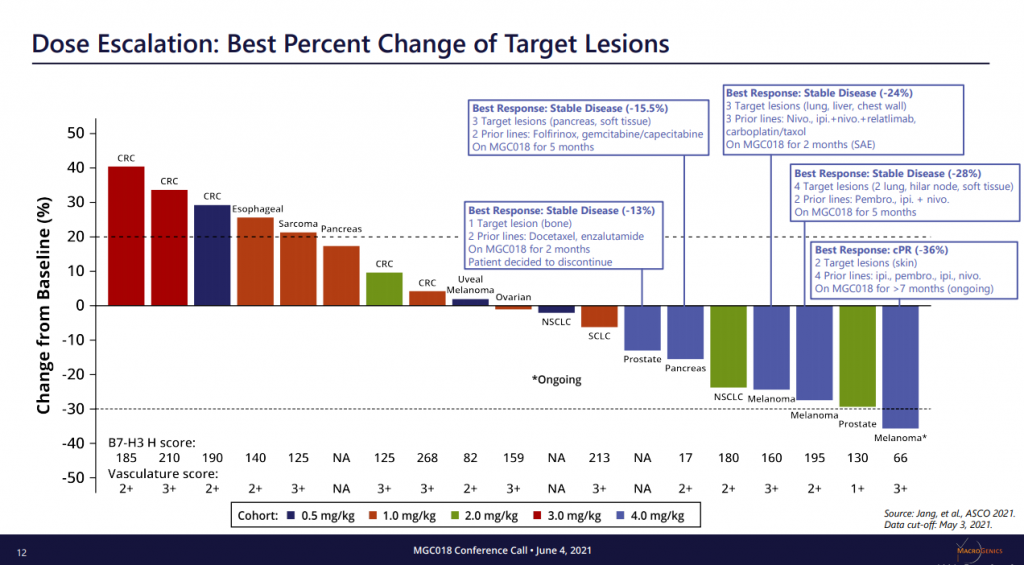 資料來源︰ASCO 2021 (圖三)
資料來源︰ASCO 2021 (圖三)
MGC018同時顯示針對前列腺癌患者的強大臨床活性。在AACR2021上,對於多種頭頸癌PDX模型,MGC018顯著地抑制腫瘤生長,表現出強大的抗腫瘤效果。(詳見圖四)
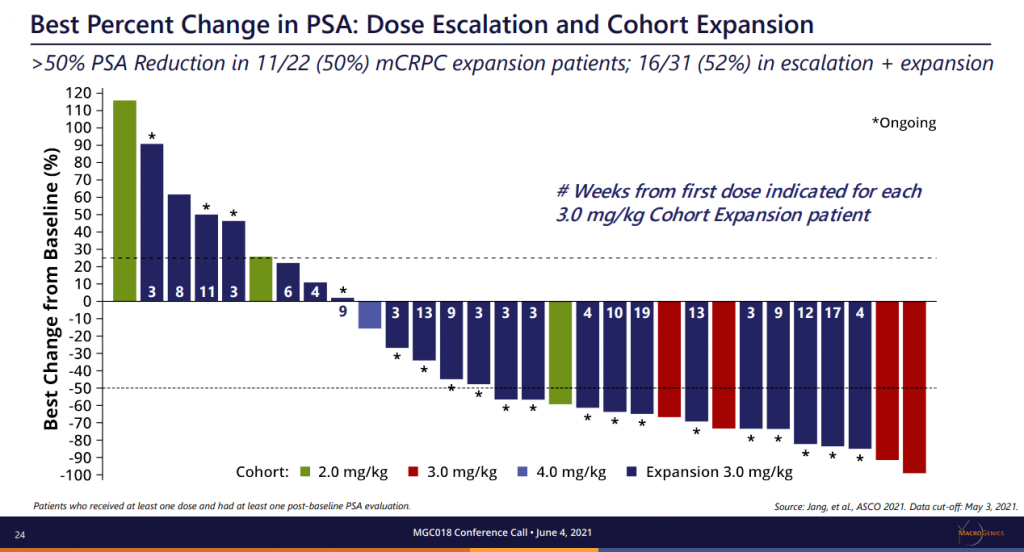 資料來源︰ASCO 2021 (圖四)
資料來源︰ASCO 2021 (圖四)
FDA特批的5位「希望之藥」
1. Sotorasib – 針對靶點KRAS
今年5月28日FDA批准Lumakras(Sotorasib)用於治療攜帶KRASG12C突變的非小細胞肺癌(NSCLC),成為「不可成藥」的靶點KRAS的首個靶向藥物。Lumakras基於CodeBreaK100臨床研究的亞組結果而獲得加速批准,按照先前接受免疫治療和/或化療後進展的KRASG12C突變陽性NSCLC患者邀請124例,讓其接受劑量960 mg的Lumakras治療,總緩解率達到36%(95% CI:28-45),疾病控制率為81%(95% CI:73-87),中位緩解持續時間為10個月。(詳見圖五)
 資料來源:WCLC2020 (圖五)
資料來源:WCLC2020 (圖五)
Lumakras(Sotorasib)獲批上市後或會降低關注度。不過,在ASCO 2021會議上,因為Lumakras首次披露CodeBreaK100臨床Ⅱ期研究的總生存期和探索性亞組分析數據。其結果顯示治療 KRASG12C突變NSCLC患者的mOS達到12.5個月;亞組分析結果顯示先前接受PD-1/L1治療的患者mOS為17.7個月。(詳見圖六、圖七和圖八)
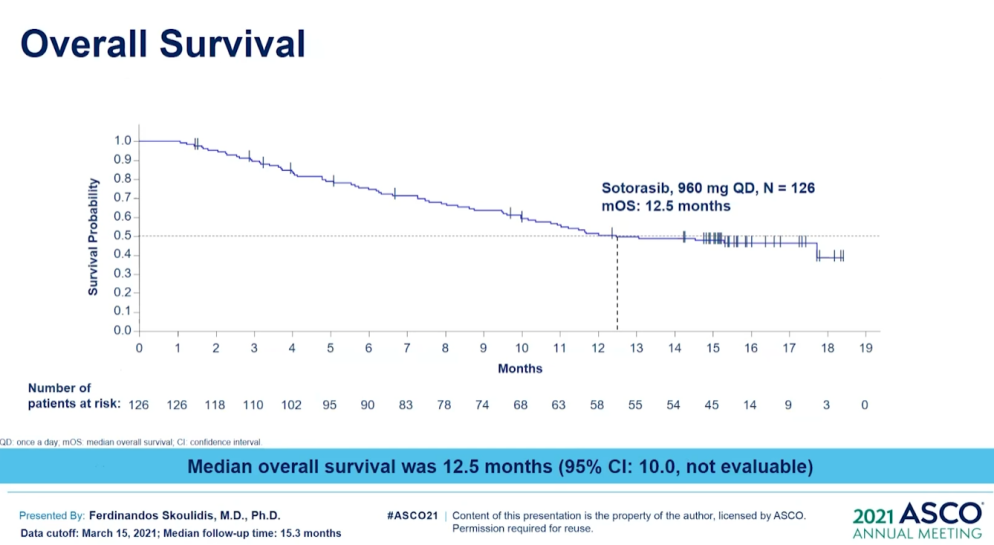 資料來源︰ASCO 2021 (圖六)
資料來源︰ASCO 2021 (圖六)
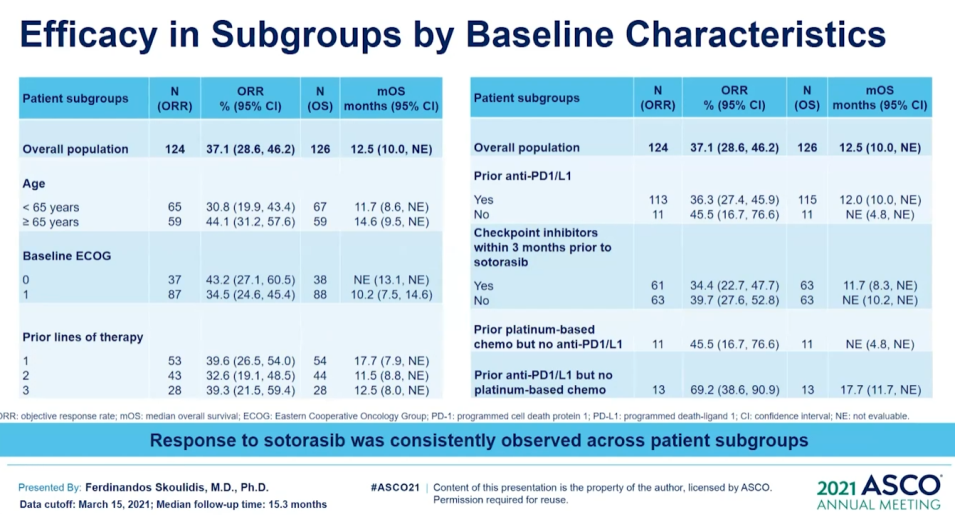 資料來源︰ASCO 2021 (圖七)
資料來源︰ASCO 2021 (圖七)
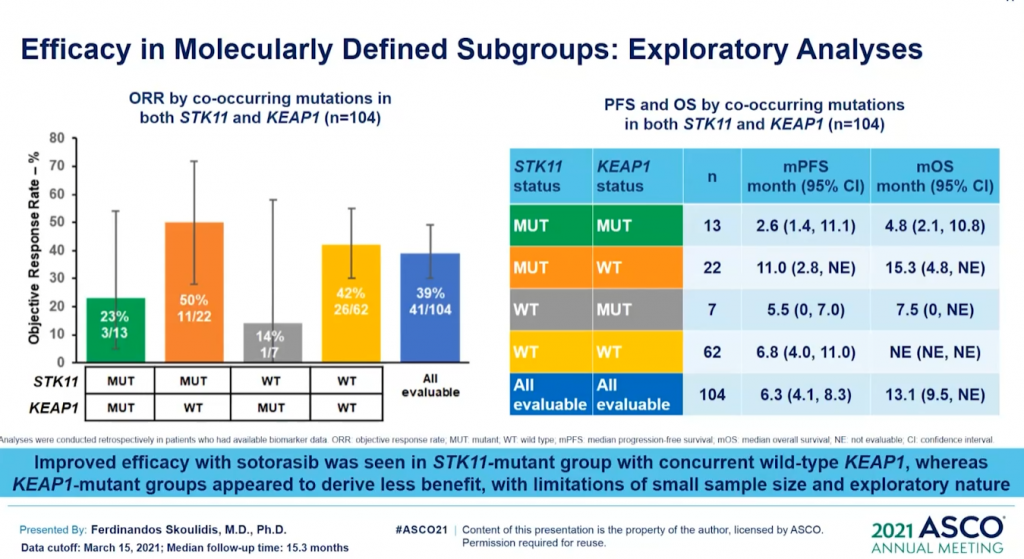 資料來源︰ASCO 2021 (圖八)
資料來源︰ASCO 2021 (圖八)
值得一提,根據一項約8萬人測序分析,再次確證非G12C突變(G12D, G12V)佔據更多的KRAS突變比例 (詳見圖九)。藥物Lumakras上市固然可喜,不過面對這曾屬於「不可成藥」的靶點,仍需要繼續深入探索。
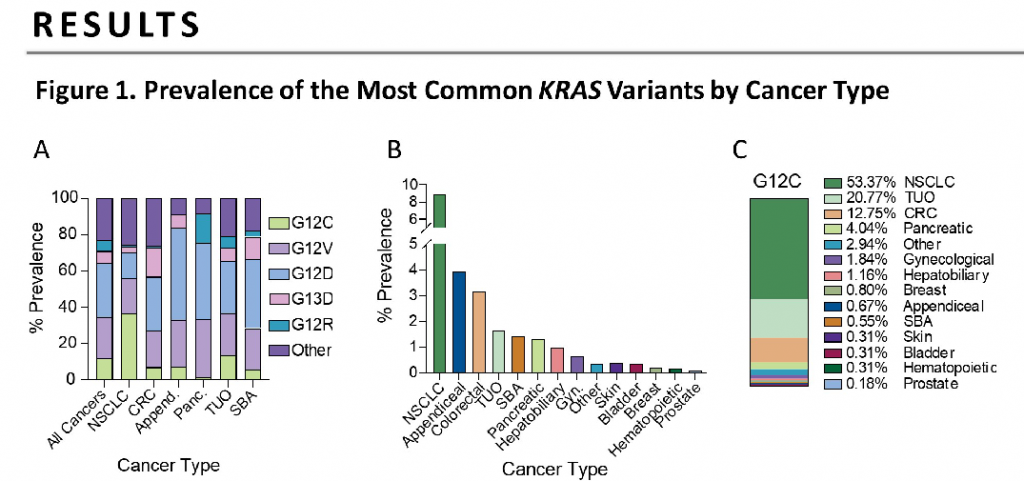 圖片來源:ASCO 2021 (圖九)
圖片來源:ASCO 2021 (圖九)
2. Amivantamab – 針對EGFR外顯子20插入突變的成年非小細胞肺癌(NSCLC)首個治療方法
Amivantamab於2021年5月22日同樣獲得FDA加速批准,成為EGFR外顯子20插入突變的成年非小細胞肺癌(NSCLC)首個治療方法。在WCLC 2020會議期間公布以針對該人群的治療數據(Abs#3031),Amivantamab治療ORR為40%,中位反應持續時間11.1個月。(詳見圖十)
 資料來源:WCLC 2020 (圖十)
資料來源:WCLC 2020 (圖十)
此外,我們可關注Amivantamab聯合EGFR-TKI三代藥物Lazertinib用於治療奧希替尼復發、未接受化療的 EGFR 突變NSCLC的研究。在45例奧希替尼治療復發患者的結果顯示分析,36%有確認反應(1個CR,15個PR)。中位隨訪時間8.2個月,44%(20/45)患者仍在接受治療,69% (11/16)的回應患者持續緩解(≥6個月),mPFS為4.9個月,仍未達到中位緩解持續時間。(詳見圖十一)
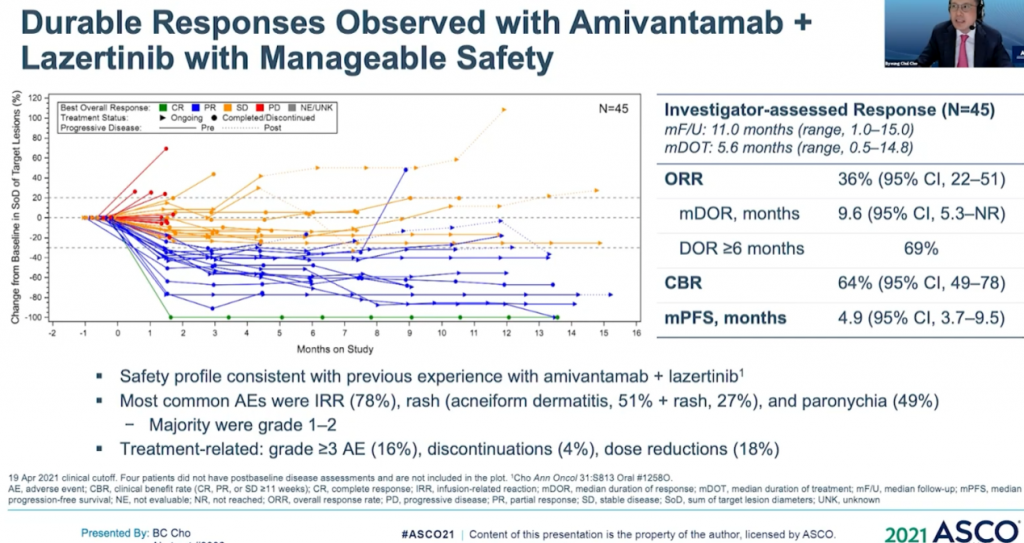 資料來源:ASCO 2021 (圖十一)
資料來源:ASCO 2021 (圖十一)
通過生物標記物分析,這些相應患者更多是基於藥物機制的正常治療作用。他們通過ctDNA 進行評估44患者,29例經NGS評估。基因檢測確定了17例的生物標誌物屬陽性患者,其中8例(47%)有反應;其餘 28 例患者,僅8例(29%)對治療有相應。(詳見圖十二)
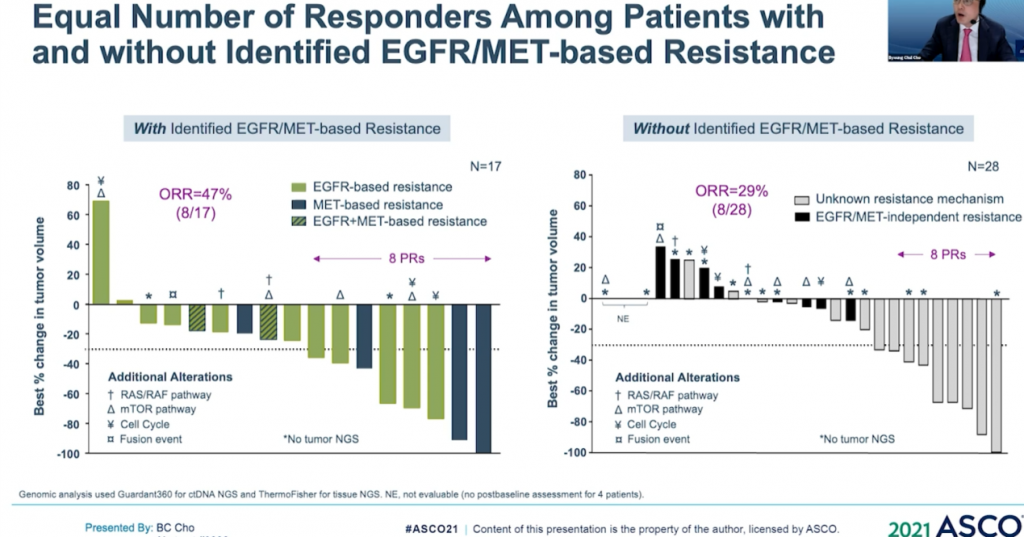 資料來源:ASCO 2021 (圖十二)
資料來源:ASCO 2021 (圖十二)
以28名患者為例,18例的耐藥機制未知(8名PR),10例屬非EGFR/MET耐藥機制(無應答)。生物標誌物屬陽性和陰性患者的mPFS分別為 6.7個月(3.4-NR)和4.1個月(1.4-9.5)。9/10(90%) IHC 高(EGFR+MET H組合評分>400)患者對治療有反應,而IHC低患者僅1/10對治療有反應。(詳見圖十三)
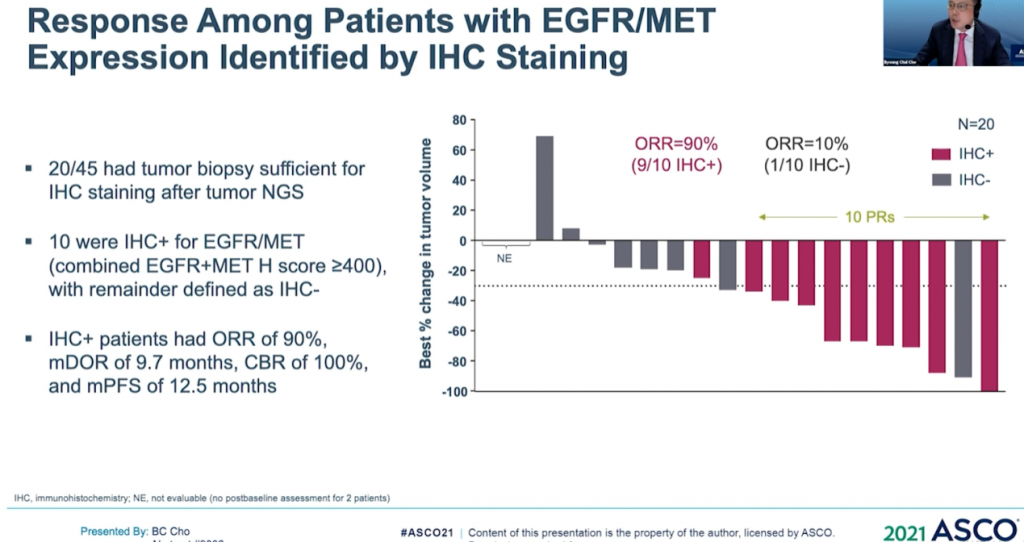 資料來源:ASCO 2021 (圖十三)
資料來源:ASCO 2021 (圖十三)
3.Kisqali(瑞波西利)- 創造絕經前女性HR+/HER2-轉移性乳腺癌最長OS結果
Kisqali作為全球第二款上市的CDK4/6抑制劑,於本會議上Ribociclib更新了一線治療絕經後HR+/HER2-轉移性乳腺癌的總生存期(OS)數據。從MONALEESA-7研究證實了Ribociclib聯合內分泌治療的中位OS接近5年(58.7個月),創造了絕經前女性HR+/HER2-轉移性乳腺癌最長OS結果。
ASCO 2021公布一項III 期MONALEESA-3研究(NCT02422615)探索性分析數據。早前數據已表明Ribociclib聯合氟維司群較安慰劑聯用氟維司群,無論一線還是二線治療,均顯著改善絕經後女性HR+/HER2−轉移性乳腺癌OS(未達到 vs 40.0個月;HR,0.72;95% CI,0.57-0.92,P=.00455)。是次公布數據是額外中位16.9 個月的隨訪後,對 OS 進行探索性分析。
在(2020年10月30日)截止時,該數據顯示中位隨訪時間為 56.3 個月。68例(14.0% vs8.7%)仍在接受Ribociclib聯合氟維司群的治療。經過此次延長的隨訪,Ribociclib聯合氟維司群繼續顯示OS獲益(mOS:53.7vs 41.5 m;HR,0.73;95% CI,0.59-0.90)。此外,Ribociclib聯合氟維司群在1L(mOS,未達到 vs 51.8m;HR,0.64;95% CI,0.46-0.88)和 2L 亞組(mOS,39.7 vs33.7 mo;HR,0.78;95)中也顯示更長的OS獲益。
4. Enhertu(DS-8201) – 拓展多種適應症領域,並打破ADC藥物常規「教條」
Enhertu(Trastuzumab deruxtecan,T-DXd;DS-8201)作為ADC領域的明星藥物,備受關注。它不僅拓展多種適應症領域,並打破ADC藥物常規「教條」。
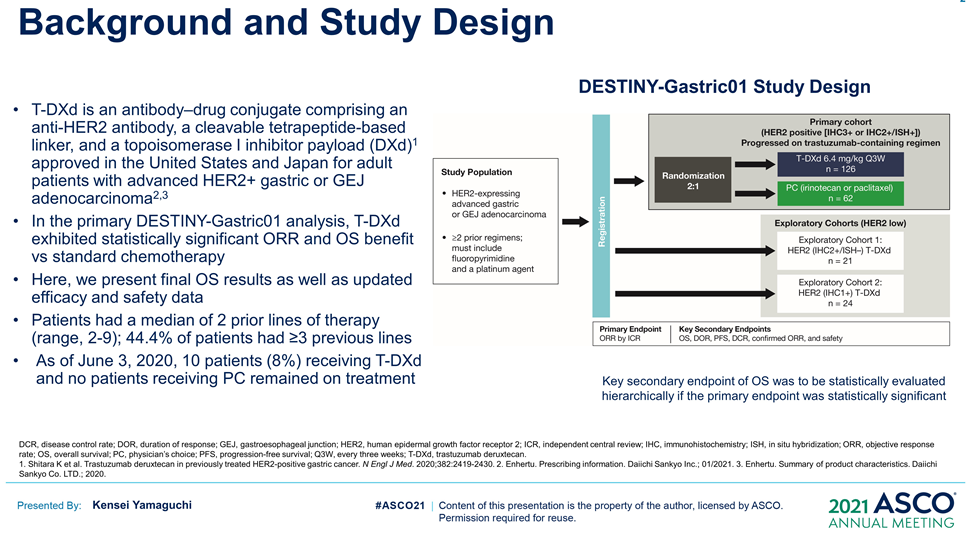
根據Enhertu的一項隨機、多中心治療 HER2 陽性晚期胃或胃食管交界處 (GEJ) 腺癌的臨床Ⅱ期研究(DESTINY-Gastric01)最終OS數據公布,共納入187例,幾乎全部為亞洲患者(日本:79.7%,韓國:20.3%)。125例接受T-DXd;患者中位接受先前2線及以上治療,44.4%為3 線以上。(詳見圖十四)
 資料來源:ASCO 2021 (圖十四)
資料來源:ASCO 2021 (圖十四)
按照(2020年6月3日)截止時的數據分析,8%患者仍在接受T-DXd(中位生存期隨訪:18.5 個月)治療,而接受醫生選擇的治療對照組(PC:伊立替康 [I] 或紫杉醇 [P])為0%。T-DXd與PC相比,OS得到改善(mOS:12.5vs 8.9 m;HR:0.60);12個月OS分別為52.2%和29.7%。T-DXd治療的ORR為51.3%(61/119;11 CR,50 PR),而PC為14.3%(8/56;全部為PR),確認的ORR(42.0% vs12.5%)、DCR (86.6% vs 62.5%)、mDOR(12.5vs 3.9 m)、mPFS(5.6 vs 3.5 m; HR:0.47)也顯著更高。(詳見圖十五、圖十六)
 資料來源:ASCO 2021 (圖十五)
資料來源:ASCO 2021 (圖十五)
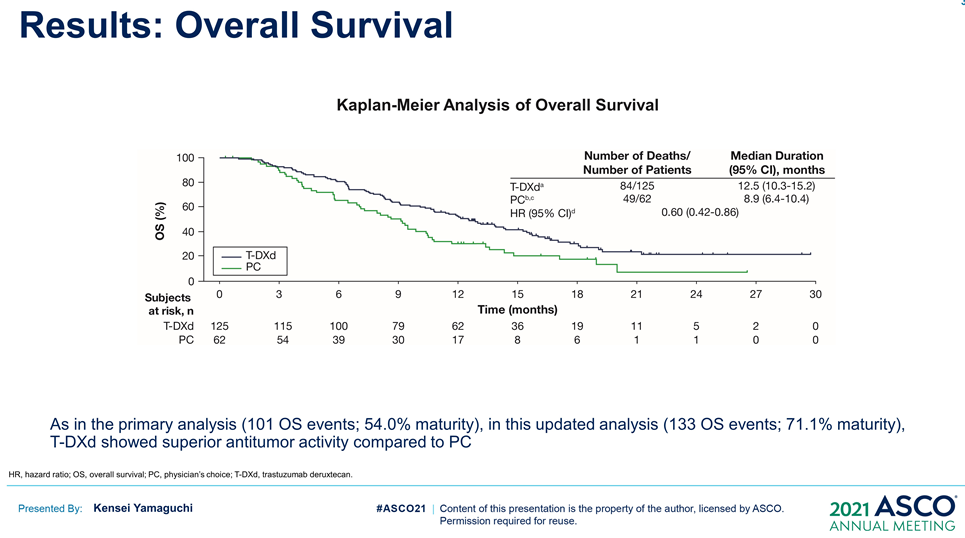 資料來源:ASCO 2021 (圖十六)
資料來源:ASCO 2021 (圖十六)
Enhertu除了研究HER2陽性晚期胃或胃食管交界處 (GEJ) 腺癌,同時也開展針對HER2陰性的胃癌研究。
5. 特瑞普利單抗(Toripalimab)- 首個向FDA提交上市申請的國產PD-1,並且在鼻咽癌適應症上獲FDA BTD認證
特瑞普利單抗是首個上市的國產PD-1產品,亦是最前列邁向國際化進程的藥物,它同時是首個向FDA提交上市申請的國產PD-1並鼻咽癌適應症上獲FDA BTD認證。在ASCO 2021會議上,特瑞普利公布一線治療復發/轉移性鼻咽癌(r/m NPC)的國際多中心、雙盲、安慰劑對照、III期臨床註冊研究(JUPITER-02)結果,並被ASCO收錄為重磅研究摘要(LateBreaking Abstract,LBA)。
JUPITER-02研究顯示,與單純化療相比,特瑞普利單抗聯合化療組的PFS顯著延長(HR =0.52),mPFS為11.7 vs 8.0個月。特瑞普利單抗聯合化療組和安慰劑聯合化療組1年PFS率分別為49%和28%。包括PD-L1表達水準亞組在內的所有相關亞組中,均觀察到特瑞普利單抗聯合化療組的PFS改善。截至2021年1月15日時,其OS尚未成熟,有待跟進發展。
此外,特瑞普利單抗聯合化療組和安慰劑聯合化療組的客觀緩解率(ORR)分別為77.4%vs 66.4%(P =0.033),中位緩解持續時間(DOR)為10.0 vs5.7個月(HR=0.50,95%CI:0.33-0.78)。
臨床研發中的焦點藥物
1. First in class的口服CD11b調節劑GB1275
儘管檢查點免疫療法已經徹底改變了癌症治療,但並表示所有類別的腫瘤均具體得益,例如高度致命的胰腺導管腺癌 (PDAC) 就是一例,它對免疫療法的反應就非常有限了。
PDAC中廣泛的免疫抑制性骨髓細胞浸潤被認為是免疫治療抵抗的主要機制。據知CD11b/CD18是一種在這些骨髓細胞亞群細胞表面上高度表達的整合素分子,並在炎症組織轉運和細胞功能中起重要作用。GB1275是First-in-Class的口服CD11b調節劑,可減少髓源性抑制細胞 (MDSC) 和腫瘤相關巨噬細胞 (TAM),並將M2免疫抑制性TAM重新極化為M1表型,從而增加活化CD8+ T細胞的腫瘤浸潤,並在臨床前模型中顯示了抗腫瘤功效。
回顧ASCO 2021會議上,GB1275公布了一項單藥和聯合帕博利珠單抗的臨床研究設計(KEYNOTE-A36)和早期的體內PK特性;今次GB1275則帶來早期臨床活性的證據。截至2021年1月8日止,就有45名受試者接受治療,當中可評估的受試者,GB1275單藥顯示31.6%(6/19)的SD,聯合用藥中報告56.3%(9/16) SD。在聯合用藥組 (GB1275,800 mg),1例接受263天治療的MSS-CRC(一種腫瘤微環境中浸潤淋巴細胞水準較低,常導致免疫檢查點抑制劑單藥幾乎無效的亞型)受試者報告了PR,1例胃癌(GC)患(因疾病進展先前接受帕博利珠單抗加巴土昔單抗治療不到3個月)報告長期SD(227天);兩例受試者都在繼續接受治療。
GB1275單藥和聯合用藥均觀察到外周MDSC 的下調和腫瘤浸潤淋巴細胞 (TIL) 計數增加。
2. First-in-Class的RAD51抑制劑CYT-0851
同源重組 (HR) 是修復 DNA 雙鏈斷裂 (DSB) 必不可少的高保真性機制。RAD51蛋白對修復受損的DNA至關重要,RAD51蛋白在斷裂處與DNA結合,並將其包裹在蛋白鞘中,完成修復過程中的必要第一步。在許多正常細胞的細胞核中,RAD51蛋白與其他許多蛋白相互作用,包括BRCA1/BRCA2,以修復受損的DNA。(詳見圖十七)
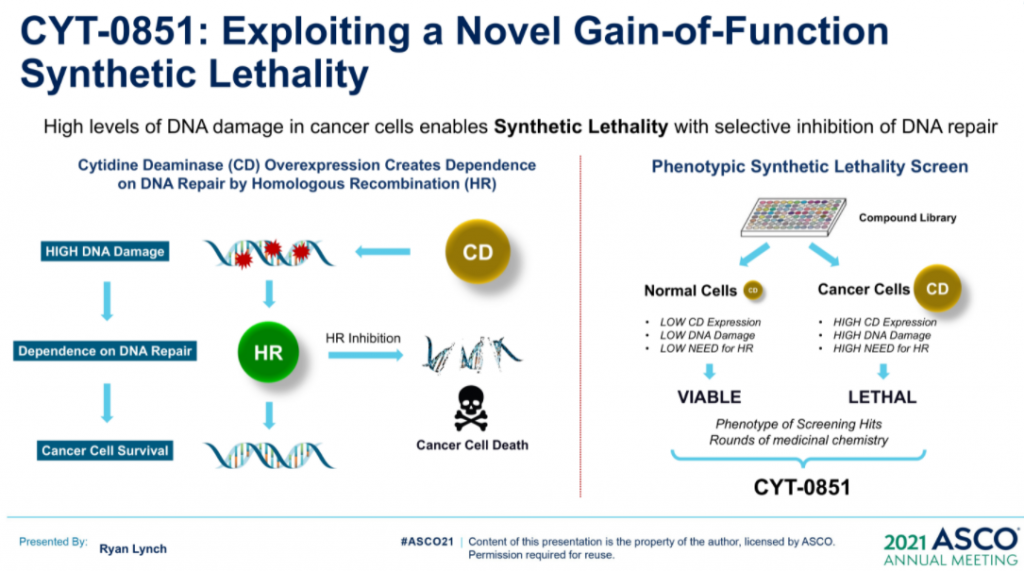 資料來源:ASCO 2021 (圖十七)
資料來源:ASCO 2021 (圖十七)
數據的截止日期 (DCO,2020年12月8日),23例晚期癌症患者(肉瘤:n=8;乳腺:n=4;非霍奇金淋巴瘤:n=5;胰腺:n=3;卵巢:n=2;粘液表皮樣癌:n=1) 被納入6個佇列(15 mg、20 mg、30 mg和45 mgBID;90 mg和130 mg QD),尚未報告劑量限制性毒性。在DCO前,10例反應可評估的。兩例接受45 mgBID治療超126天和250天的DLBCL (-74%) 和粘液纖維肉瘤 (-30%) 患者根據Lugano和RECISTv1.1標準顯示PR。另外,1例胰腺癌(-19%)和1例濾泡性淋巴瘤(-42%)在接受45mg BID治療時獲得SD,其腫瘤縮小持續在111天和99天以上。(詳見圖十八)
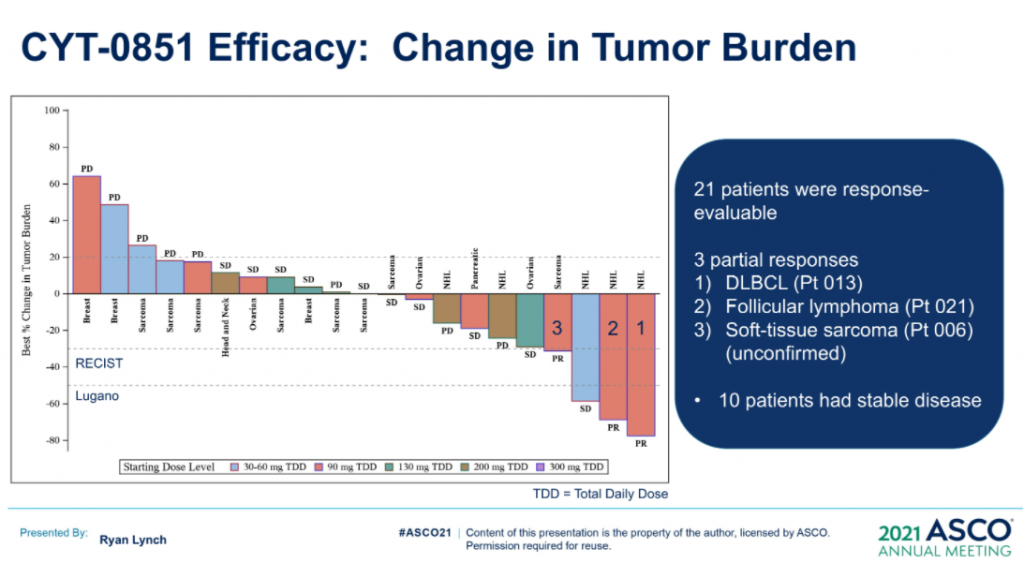 資料來源:ASCO 2021 (圖十八)
資料來源:ASCO 2021 (圖十八)
CYT-0851是First-in-Class的RAD51抑制劑,具有良好耐受性。6例 (26.1%)經歷了CYT-0851相關不良事件,只有1/2級噁心 (n=3,13%)和便秘 (n=2,8.7%)的患者數量在1例以上。CYT-0851是第一種在血液系統惡性腫瘤和實體瘤中均具有臨床活性DNA 損傷修復 (DDR) 治療劑。
3. First-in-class人源化IgG4單體COM701
COM701是一種新型的First-in-class人源化IgG4單克隆抗體,可與含有脊髓灰質炎病毒受體相關免疫球蛋白結構域 (PVRIG)高親和力結合,阻斷其與其配體 PVRL2 的相互作用,更阻斷PVRIG可增強T/NK細胞的活化,並在小鼠模型中抑制腫瘤生長。
COM701雖然多次在ASCO註冊,但更多是臨床實驗設計和動態預告。是次COM701帶來針對晚期實體惡性腫瘤的早期臨床數據。在招募51名DLT可評估患者中:A組(COM701 單劑量遞增)8個佇列納入16例患者(0.01-20mg/kg,IV Q3/4 wks);B組(COM7010.3-20 mg/kg + nivolumab (NIVO) 360 mg/480 mg;IV Q3/Q4wks)5個佇列共納入15例患者。
A組或B組均未報告DLT。抗腫瘤活性方面,A組(佇列8),1例鉑耐藥的原發性腹膜癌患者已確認PR並持續14個月。B組(COM70110 mg/kg + NIVO 480 mg,IV Q4 wks),1例先前最後接受NIVO治療的肛門鱗狀細胞癌(SCCA)確認CR,並持續 18 個月。此外,多例不同瘤種患者獲得SD。
4. 進度最快的國產ADC緯迪西妥單抗
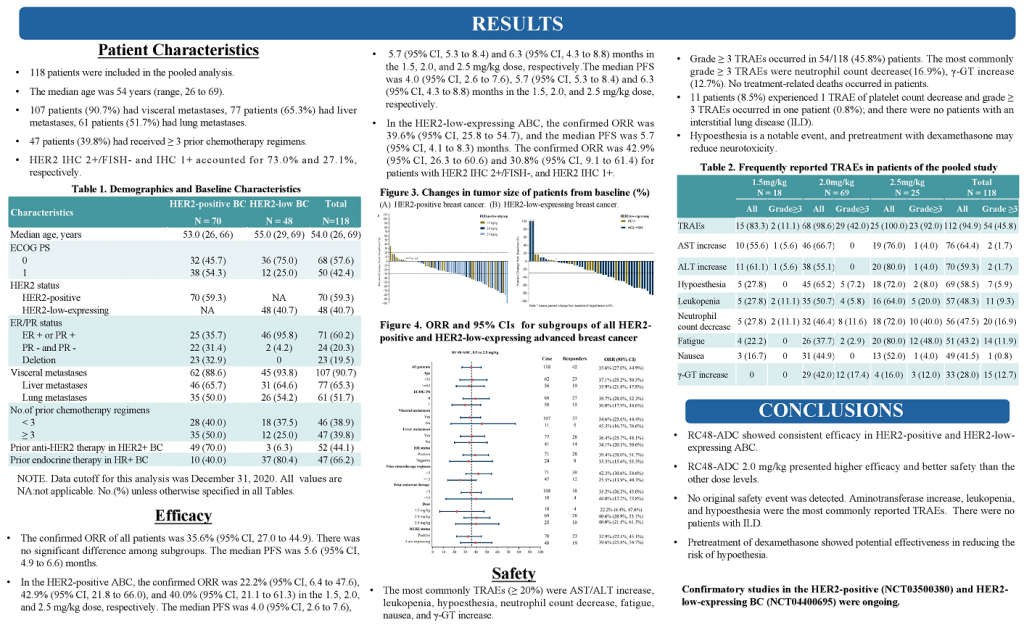
隨著ADC技術進展,ADC藥物也在不斷突破,甚至顛覆先前的治療概念。RC48作為Her2靶向ADC,在Her2陽性瘤種中不斷拓展,甚至向Her低表達進階。RC48在會議上亦有多項進展彙報,包括一項針對HER2陽性和HER2低表達的晚期或轉移性乳腺癌的匯總分析。我們不妨從中探索RC48在靶標不同表達水準下的治療差異。
該分析涉及C001 CANCER (NCT02881138) 和C003CANCER (NCT03052634) 兩項研究。數據截止日(2020年12月31日),共有118例女性乳腺癌患者入組並接受了RC48-ADC治療。70例患者 (59.3%) 為HER2陽性,48例(40.7%)為HER2低表達。在HER2低表達亞組中,ORR和mPFS分別為39.6%和5.7個月。IHC 2+/FISH-(HER2陽性)患者的ORR和mPFS分別為42.9%(15/35)和5.7個月。對於IHC 1+患者(Her2低表達),即使COVID-19大流行導致一些治療推遲,ORR也達到30.8%(4/13)。(詳見圖十九)
 資料來源:ASCO 2021 (圖十九)
資料來源:ASCO 2021 (圖十九)
根據以上得知,從RC48-ADC在HER2陽性和HER2低表達亞組分析,相同治療劑量下(2.0mg/kg)的ORR(42.9% vs39.6%)和mPFS(5.7 vs 5.7 m)顯示出相對一致的療效潛力。
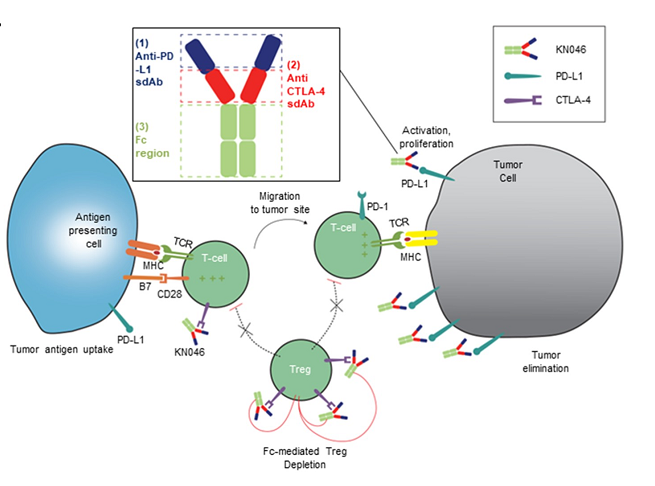
5. PD-L1/CTLA-4雙抗KN046一線治療NSCLC
KN046是一種新型PD-L1/CTLA-4雙特異性抗體,可阻斷PD-L1與PD-1/CD80、CTLA-4與CD80/CD86的相互作用。於ASCO 2021會議報告針對初治IV期 NSCLC 患者的療效和安全性,符合條件的患者可接受KN046聯合含鉑化療。(詳見圖二十)
 資料來源:ASCO 2021 (圖二十)
資料來源:ASCO 2021 (圖二十)
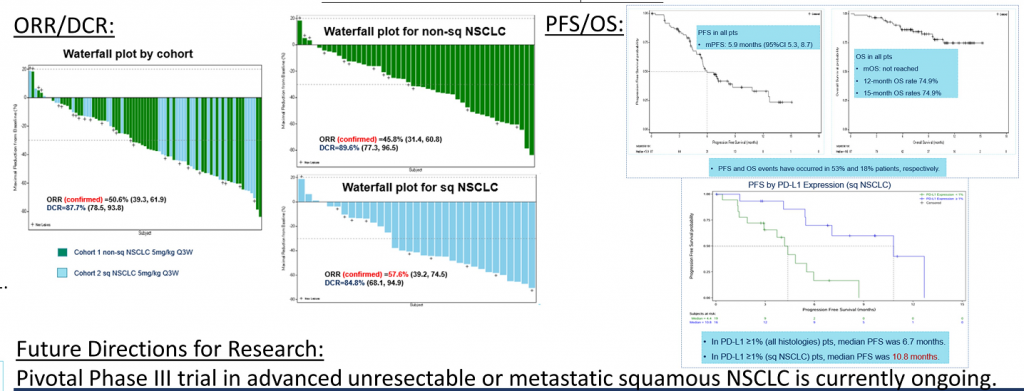
截至2021年1月19日,87例入組,其中83例具有腫瘤PD-L1表達數據(PD-L1 ≥1%:55.4%;PD-L1<1%:44.6%)。33.3%繼續接受研究治療,66.7%因疾病進展 (27.6%)、TEAE(13.8%)、死亡 (9.2%) 和其他原因 (16%) 停止治療。在81例可評估療效中,ORR為50.6%,DCR為87.7%, mPFS為5.9 , mOS未達到,12個月和15個月的OS率為74.9%。非鱗NSCLC患者(n=8)ORR 和DCR分別為45.8%和89.6%,鱗狀非小細胞肺癌患者(n=33)ORR和DCR分別為57.6%和84.8%。在PD-L1≥1%的患者中,mPFS為6.7個月(PD-L1≥1%的鱗狀非小細胞肺癌患者為10.8個月)。(詳見圖二十一)
 資料來源:ASCO 2021 (圖二十一)
資料來源:ASCO 2021 (圖二十一)
兩者相對比較下,納武利尤單抗聯合伊匹木單抗(PD-1+CTLA4)治療PD-L1≥1%的IV期或復發NSCLC研究(CheckMate227)中,mOS為 17.1 個月;阿替利珠單抗(PD-L1)單藥治療IV非鱗或鱗狀NSCLC的研究(IMpower110)中,mOS達到20.2個月。多數雙特異性抗體在擁有了先進治療機制之後,能否在臨床中顯示超越單抗或聯合治療的臨床獲益,仍需持續跟進發展。